Vertiefung II
pH - Berechnungen -
Herleitung der Näherungsformeln
1. Starke Säuren / Basen
Starke
Säuren und Basen dissoziieren praktisch vollständig: HA  H+ + A- (100%) bzw. BOH
H+ + A- (100%) bzw. BOH  B+ + OH- (100%). Die Stoffmengenkonzentration von H+
ist damit gleich der Stoffmengenkonzentration der Säure; die Stoffmengenkonzentration
von OH- ist gleich der Stoffmengenkonzentration der Base.
B+ + OH- (100%). Die Stoffmengenkonzentration von H+
ist damit gleich der Stoffmengenkonzentration der Säure; die Stoffmengenkonzentration
von OH- ist gleich der Stoffmengenkonzentration der Base.
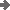 Aus der Theorie ist bekannt, dass exakt nicht die Stoffmengenkonzentration
sondern die "Aktivität" verwendet werden sollte.
Aus der Theorie ist bekannt, dass exakt nicht die Stoffmengenkonzentration
sondern die "Aktivität" verwendet werden sollte.
Es gilt a =
f * c, f = "Aktivitätskoeffizient. Für abschätzende Näherungsrechnungen
wird f = 1 benutzt; die Aktivität ist dann gleich der Stoffmengenkonzentration.
Als Richtwert gilt, dass für Konzentrationen kleiner als ca. 0,1 mol/l
die Näherungsberechnung hinreichend genau ist.
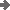 Aus der Theorie der chemischen Gleichgewichte ist bekannt, dass in Wasser
das Produkt der Konzentrationen der H+- und der OH--Ionen
einen festen Wert besitzt. (Exakt müssten auch hier wieder die Aktivitäten
benutzt werden.)
Aus der Theorie der chemischen Gleichgewichte ist bekannt, dass in Wasser
das Produkt der Konzentrationen der H+- und der OH--Ionen
einen festen Wert besitzt. (Exakt müssten auch hier wieder die Aktivitäten
benutzt werden.)
Dieses "Ionenprodukt des Wassers" KW =
c(H+) * c(OH-) hat den Zahlenwert von ca. 10-14.
(Der genaue Wert ist temperaturabhängig.)
In Analogie zur Definition des
pH-Werts, pH = - log( c(H+) ), wurde logarithmisch der pK-Wert definiert:
pKW = - log( KW ) = 14; ebenso wurde definiert: pOH =
- log( c(OH-) ). Für Basen gilt c(H+) = KW
/ c(OH-); logarithmiert pH = pKW - pOH = 14 - pOH.
2. Schwache Säuren
Schwache
Säuren dissoziieren nicht vollständig: HA  H+ + A- ( <100%). In einer wässrigen Lösung
einer schwachen Säure HA kommen daher alle 3 Teilchensorten vor - HA,
H+ und A-. Auch dafür ist aus der Theorie der chemischen
Gleichgewichte ein wichtiges Ergebnis bekannt: Die Konzentrationen der drei
Teilchensorten hängen über eine "Gleichgewichtskonstante"
K zusammen! Für Säuren benutzt man häufig auch die Namen "Dissoziationskonstante"
oder "Säurekonstante" und verwendet das Symbol KS
bzw. die logarithmierte Größe pKS = - log( KS
). Die Theorie gibt auch an, wie dieser Zusammenhang aussieht: "Konzentrationen
der Produkte" / "Konzentrationen der Edukte". (Ganz genau müssten
auch dabei wieder die "Aktivitäten" verwendet werden.)
H+ + A- ( <100%). In einer wässrigen Lösung
einer schwachen Säure HA kommen daher alle 3 Teilchensorten vor - HA,
H+ und A-. Auch dafür ist aus der Theorie der chemischen
Gleichgewichte ein wichtiges Ergebnis bekannt: Die Konzentrationen der drei
Teilchensorten hängen über eine "Gleichgewichtskonstante"
K zusammen! Für Säuren benutzt man häufig auch die Namen "Dissoziationskonstante"
oder "Säurekonstante" und verwendet das Symbol KS
bzw. die logarithmierte Größe pKS = - log( KS
). Die Theorie gibt auch an, wie dieser Zusammenhang aussieht: "Konzentrationen
der Produkte" / "Konzentrationen der Edukte". (Ganz genau müssten
auch dabei wieder die "Aktivitäten" verwendet werden.)
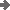 Für HA
Für HA  H+ + A- gilt: KS = c(H+) * c(A-)
/ c(HA).
H+ + A- gilt: KS = c(H+) * c(A-)
/ c(HA).
Wenn eine Säure HA dissoziiert (d.h. in die anderen Teilchen
H+ und A- zerfällt), zeigt die Reaktionsgleichung,
dass gleich viele H+ und A- entstehen. Damit ist c(H+)
= c(A-). Es gilt dann auch KS = c(H+)2
/ c(HA). ("GLEICHUNG A")
c(HA)
ist die Konzentration der nach (!) dem Zerfall in der Lösung vorhandenen
nicht dissoziierten HA-Teilchen. Wenn cS die Konzentration der Säure
vor (!) der Dissoziation ist, gilt c(HA) =cS - c(H+).
(Für jedes gebildete H+ und A- ist ein HA weniger
vorhanden.)
Daraus folgt: KS = c(H+)2 / [ cS
- c(H+) ].
Aufgelöst ist dies eine quadratische Gleichung
für c(H+): c(H+)2 + KS*c(H+)
- KS*cS = 0.
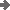
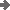 Man kann
die Sache noch weiter komplizieren: Auch Wasser dissoziiert! Damit enthält
eine Lösung einer Säure HA neben H2O-Molekülen die
Teilchen HA, H+, A- und OH-. H+
und OH- sind über KW miteinander verknüpft.
Auch dies ist über die Theorie der chemischen Gleichgewichte berechenbar.
Man kann
die Sache noch weiter komplizieren: Auch Wasser dissoziiert! Damit enthält
eine Lösung einer Säure HA neben H2O-Molekülen die
Teilchen HA, H+, A- und OH-. H+
und OH- sind über KW miteinander verknüpft.
Auch dies ist über die Theorie der chemischen Gleichgewichte berechenbar.
Es entsteht dann die noch kompliziertere Formel: c(H+) - KW
/ c(H+) - KS*cS / [ KS + c(H+)
] = 0.
(Aufgelöst eine Gleichung dritten Grades für c(H+)!)
("GLEICHUNG B")
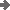 Anstelle sich mit diesen Formeln herumzuschlagen, führt man eine
Näherung ein: Schwache Säuren dissoziieren gering (Richtwert = einige
%). Damit ist die Konzentration der in der Lösung vorhandenen undissoziierten
Teilchen HA praktisch gleich der Konzentration der gesamten Säure cS.
Anstelle sich mit diesen Formeln herumzuschlagen, führt man eine
Näherung ein: Schwache Säuren dissoziieren gering (Richtwert = einige
%). Damit ist die Konzentration der in der Lösung vorhandenen undissoziierten
Teilchen HA praktisch gleich der Konzentration der gesamten Säure cS.
"Gleichung A" wird damit einfacher: KS = c(H+)2
/ cS; aufgelöst c(H+)2 = KS
* cS bzw. c(H+) = [ KS * cS ]1/2.
Dies ist die vorher angegebene Formel. Logarithmiert entsteht daraus die angegebene
"alternative Formel".
3. Schwache Basen
Für
schwache Basen gelten genau dieselben Überlegungen!
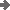 Für die Dissoziation BOH
Für die Dissoziation BOH  B+ + OH- wird eine Basenkonstante KB = c(B+)
* c(OH-) / c(BOH) eingeführt. Die weiteren Ableitungen sind
analog, wenn c(H+) durch c(OH-), cS durch
cB und KS durch KB ersetzt werden!
B+ + OH- wird eine Basenkonstante KB = c(B+)
* c(OH-) / c(BOH) eingeführt. Die weiteren Ableitungen sind
analog, wenn c(H+) durch c(OH-), cS durch
cB und KS durch KB ersetzt werden!
Es folgt
die angegebene Näherungsformel c(OH-) = [ KB * cB
]1/2 und deren logarithmierte "alternative Formel".
Der
pH-Wert wird mit pH = 14 - pOH errechnet.
 Der Vorteil dieses Wegs über OH- ist, dass gleichartige
Ableitungen und Formeln wie für die Säure benutzt werden. Ein Weg
über die zu einer Base "konjugierte Säure" ist prinzipiell
auch möglich, bietet aber keine Vorteile. (Unterrichtserfahrung: meistens
werden dann falsche Formeln hergeleitet!)
Der Vorteil dieses Wegs über OH- ist, dass gleichartige
Ableitungen und Formeln wie für die Säure benutzt werden. Ein Weg
über die zu einer Base "konjugierte Säure" ist prinzipiell
auch möglich, bietet aber keine Vorteile. (Unterrichtserfahrung: meistens
werden dann falsche Formeln hergeleitet!)
4. Gültigkeit der Näherungsformeln
für schwache Säuren/Basen
Die Näherungsformel
ist dann gut benutzbar, wenn für die Zahlenwerte gilt: cS >
100 * KS (bzw. cB > 100 KB).
Als Beispiel
einige Ergebnisse für Essigsäure (pKS = 4,75; KS
= 1,778*10-5).
|
Konzentration cS
(in mol/l)
|
Näherungsformel
|
Gleichung A
|
Gleichung B
|
|
10-1
|
2,875
|
2,878
|
2,878
|
|
10-3
|
3,875
|
3,904
|
3,904
|
|
10-5
|
4,875
|
5,147
|
5,146
|
|
10-7
|
5,875
|
7,002
|
6,793
|
|
10-9
|
6,875
|
9,000
|
6,998
|
Bei 10-3 mol/l ist die Näherungsformel noch
gut brauchbar (0,7 % Abweichung); im Bereich von KS ist die Abweichung
deutlich (5,3 %); die scheinbar "bessere" Formel, die quadratische
Gleichung A, liefert völlig falsche Resultate bei cS <
KS / 100.
|

|
Am besten benutzt man für cS > 100
* KS die Näherungsformel und sonst die exakte Formel Gleichung
B!
|
ZURÜCK: Einführung
Formeln für die pH-Berechnung