Zweck: Tatsächliche Strukturen sollen mit den gewohnten Strichformeln
beschrieben werden.
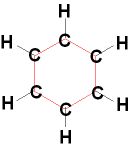
Das Standardbeispiel dazu ist Benzol
C6H6.
|
Die tatsächliche Struktur ist ein
regelmäßiges Sechseck der C-Atome.
Die Bindungswinkel
120° können durch eine sp2-Hybridisierung
der
C-Atome erklärt werden.
|
|
|
Der Versuch mit einer Strichformel diese Struktur
zu beschreiben, führt zu einem Widerspruch mit dem realen Verhalten.
Es
ist auch üblich, nur das Gerüst der C-Atome zu zeichnen!
Die
H-Atome werden "mit chemischem Verständnis dazu gedacht"..
Es
liegen abwechselnd Einfach- und Doppelbindungen zwischen den C-Atomen
vor. Da eine Einfach- und Doppelbindung verschieden lang sind, kann
so ein regelmäßiges Sechseck nicht erzeugt werden!
|
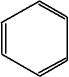
so?
|
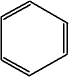
oder
so?
|
|
... beides ist falsch
!!!
|
Als Lösung wurde 1933 von C. K. Ingold und danach von L. Pauling der
Begriff "Mesomerie" (englisch: "resonance") eingeführt:
Eine Strichformel, die die Realität beschreibt, ist nicht möglich!
Man nimmt einige fiktive (gedachte) Grenzstrukturen an, deren Überlagerung
die Wirklichkeit beschreibt.
Der Ort der Kerne ist in den verschiedenen Grenzstrukturen
gleich,
die Überlagerung beschreibt die Elektronenverteilung im Molekül
richtig.
|
Für C6H6 haben wir
folgende Lösung:
2 Grenzstrukturen können angegeben
werden.
{Sie unterscheiden sich durch die Lage
der Doppelbindung.}
Deren Überlagerung beschreibt
die Wirklichkeit richtig.
|
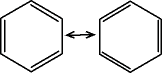
|
|
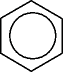
Eine Alternative ist die Einführung eines
"Sondersymbols".
Der Kreis beschreibt die gleichmäßige
Verteilung des p-Elektronensystems.
Eine
"Elektronenwolke" - mit 2 Teilzonen
ober- und unterhalb
der Ebene des ebenen Sechsrings.
|
|
Zwischen den einzelnen Grenzstrukturen wird ein "Mesomeriepfeil"
geschrieben. Nicht verwechseln mit dem Doppelpfeil für Gleichgewichte!
(Dort stellt sich durch Hin- und Rückreaktion eine mittlere konstante Konzentration
von Edukt und Produkt ein.)
|
|
Mesomeriepfeil
Die wirkliche Struktur liegt zwischen den Grenzstrukturen
|
Die CC-Bindung in C6H6 ist weder eine Einfach- noch
eine Doppelbindung.
Aus der Überlagerung ist ersichtlich, dass jeweils
zu 50% π-Charakter vorliegt, es wäre also insgesamt
eine "1,5 - Bindung".
|
 WICHTIG !!!
WICHTIG !!! 
Es handelt sich
nicht um ein
Gleichgewicht zwischen den beiden Grenzstrukturen!
Es
findet also kein Wechsel zwischen den beiden Grenzstrukturen statt!
{Dieser
könnte ja so schnell sein, dass wir nur noch das mittlere Verhalten
sehen.}
Die Überlagerung
ist die Realität!
{Stellen
Sie sich das etwa so vor:
Beide Strukturen werden auf eine Transparentfolie
gezeichnet und die Folien übereinander gelegt.
Beim Durchsehen
würde man dann keines der beiden Bilder sehen, sondern nur
ein Mittel der beiden Bilder.}
|
Vergleicht man das reale Verhalten mit dem theoretischen Verhalten einer
Grenzstruktur, findet man, dass durch die Mesomerie
ein Energiegewinn von ca.
150 kJ/mol eintritt. Man nennt dies auch die "Mesomerie-Energie".
Mesomerie kommt dann vor, wenn in einem System konjugierter Doppelbindungen
(Einfach- und Doppelbindung abwechselnd) die Elektronen nicht mehr an einer
Bindung lokalisiert sind, sondern
sich über mehrere Bindungen hinweg zu
einer gemeinsamen ("delokalisierten") Elektronenwolke ausdehnen.
{Etwas
theoretischer: Die reale Struktur wird durch Molekülorbitale beschrieben
(MO-Theorie). Wenn man bei den gewohnten Stichformeln bleibt, also lokalisierte
π-Elektronen-Verteilungen annimmt, muss eine Überlagerung eingeführt
werden (VB-Theorie).}
|
Das Konzept der Mesomerie hat sich als sehr hilfreich
zur Vorhersage des Ablaufs chemischer Reaktionen erwiesen. Das gilt
vor allem für die Organische Chemie.
Für Neugierige ein
kleines Beispiel:
|

|
|
Delokalisierte Orbitale?
Molekülorbitale?
Bitte etwas mehr Informationen
dazu!
|

|
WEITER: Beispiele
und Übungen
NUR falls links der blaue Balken fehlt: STARTSEITE




