Die Reaktionsgleichung legt fest, wieviel Moleküle miteinander für völligen Umsatz reagieren.
HCl + NaOH
H2SO4 + 2 NaOH
|
TITRATION |
I. Prinzip |
A N A L Y S E
N B E R E C H N U N G
Bei einer Titration (Maßanalyse) wird ein Stoff aus der Bürette
(der "Titrator") einem Stoff in der Vorlage
(der "Titrand"),
in der Regel ein Erlenmeyerkolben, zugetropft. Der "Endpunkt" der
Reaktion liegt vor, wenn
"äquivalente Stoffmengen" miteinander
regiert haben.
Äquivalente Stoffmengen
Die Reaktionsgleichung
legt fest, wieviel Moleküle miteinander für völligen Umsatz reagieren.
HCl
+ NaOH ![]() NaCl + H2O
: 1
Molekül HCl reagiert mit 1 Molekül
NaOH
NaCl + H2O
: 1
Molekül HCl reagiert mit 1 Molekül
NaOH
H2SO4 + 2 NaOH ![]() Na2SO4
+ 2 H2O : 1 Molekül H2SO4
reagiert mit 2 Molekülen NaOH.
Na2SO4
+ 2 H2O : 1 Molekül H2SO4
reagiert mit 2 Molekülen NaOH.
Analysenberechnung (mit Stoffmengenkonzentrationen)
Am
"Endpunkt" der Reaktion ("Äquivalenzpunkt") haben äquivalente
Mengen zweier Stoffe miteinander reagiert.
Das Verhältnis der beiden
Stoffmengen ist dasselbe wie das Verhältnis der Stoffe in der Reaktionsgleichung.
Die
Stoffmengenkonzentration ist definiert durch c = n / V;
also
ist n = c V, und
mit dem Titer t: n = c t V; c in dieser Formel
ist die "theoret." Konzentration
Die
allgemeine Formel, wenn x Moleküle von
Stoff 1 mit y
Molekülen von Stoff 2 reagieren, ist: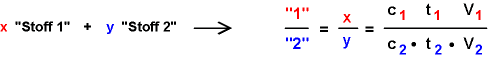
|
Beispiel: |
|
|
Im Fall x : y = 1 : 1 schreibt kann
man |
|
Mit der allgemeinen Formel kann man alle vorkommenden Analysenberechnungen
durchführen; man muss nur nach
der gesuchten Größe auflösen.
Wenn die Konzentration einer unbekannten Lösung bestimmt werden
soll, fasst man
c und t als eine unbekannte Größe zusammen.
"V"
in der Formel ist das Volumen der Lösung: Für den Stoff im Erlenmeyerkolben
also die Vorlage, für den Stoff
in der Bürette der Verbrauch.
Das ist ja gar nicht schwer! Noch einfacher wird es, wenn man einige Beispiele dazu hat! Darum: BEISPIELE