In allen Beispielen wird die Formel für 25 °C
mit dem dekadischen Logarithmus benutzt.
Zuerst Beispiele zum (rechnerischen) Umgang mit der Nernstschen
Gleichung
1) Welches Einzelpotential hat eine Halbzelle Ag
| Ag+ (a = 0,05)?
Eo = + 0,800 V; z = 1;
E = +0,800 + 0,0592 / 1 * log(0,05) = +0,723 V.
2) Welches Einzelpotential hat eine Halbzelle Ca
| Ca2+ (a = 0,3)?
Eo = -2,866 V; z = 2;
E = -2,866 + 0,0592 / 2 * log(0,3) = -2,881 V.
3) Welche EMK hat eine Zelle | Mg | Mg2+
(a=1,5) || Al3+ (a=0,08) | Al |?
Zuerst Berechnung
der Einzelpotentiale, dann EMK = E(positiver) - E(negativer).
Bei richtig
geschriebenem Symbol ist das auch: EMK = E(rechts) - E(links).
E("Mg")
= -2,363 + 0,0592 / 2 * log(1,5) = -2,358 V
E("Al") = -1,662 +
0,0592 / 3 * log(0,08) = -1,684 V
EMK = E("Al") -
E("Mg") = 0,674 V
4) Für welche Aktivität aX ist
das Einzelpotential der Halbzelle Ag | Ag+ (aX) 672 mV?
Die
Umkehrfunktion des dekadischen Logarithmus log(x) ist die Potenz 10x.
0,0592
/ z * log(a) = E - Eo; log(a) = {E - Eo} * z / 0,0592;
a = "10 hoch letzter Ausdruck";
log(aX) = {+0,672 -
(+0,800)} * 1 / 0,0592 = -2,162; aX = 10-2,162
=0,00688 ~ 0,0069 (mol/l)
5) Für welche Aktivität aX ist
die EMK der Zelle | Mg | Mg2+ (a=0,1) || Al3+ (aX)
| Al | 705 mV?
Runden Sie das Zwischenergebnis E("Mg-Halbzelle")
auf 1 mV.
E("Mg") = -2,363 + 0,0592 / 2 * log(0,1)
= -2,393 V
EMK = E("Al") - E("Mg"); E("Al")
= EMK + E("Mg") = 0,705 + (-2,393) = -1,688 V
log(aX)
= {-1,688 - (-1,662) }* 3 / 0,0592 = -1,318; aX = 10-1,318
= 0,0481 ~ 0,048 (mol/l)
{Ohne Rundung ist E("Mg")
= -2,3926; EMK = -1,6876; log(aX) = -1,29729...; aX =
0,0504}
Beispiele zur Anwendung auf die Vorhersage erwarteter
chemischer Reaktionen
6) Welche chemische Reaktion ist zwischen den Paaren
Zn | Zn2+ (a = 2) und Cr | Cr3+ (a = 0,001) zu erwarten?
E("Zn")
= -0,763 + 0,0592 / 2 * log(2) = -0,754 V
E("Cr") = -0,744 + 0,0592
/ 3 * log(0,001) = -0,803 V
Für die Eo-Werte ist "Cr"
positiver als "Zn", die Reaktion Chrom(III) oxidiert Zink zu Zink(II)
ist zu erwarten.
Für die E-Werte ist "Zn" positiver als "Cr",
die Reaktion Zink(II) oxidiert Chrom zu Chrom(III) ist zu erwarten.
{3
Zn2+ + 2 Cr 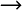 3 Zn + 2 Cr3+}
3 Zn + 2 Cr3+}
Durch
verschiedene Konzentrationen bzw. Aktivitäten können die Potentiale
so verschoben werden, dass aus
E und Eo verschiedene Aussagen
zum erwarteten Reaktionsablauf folgen!
7) Gegeben sind die Paare Sn | Sn2+ (a
=1) und Pb | Pb2+(aX). Welche Reaktion läuft ab,
wenn aX = 1?
Welche Aktivität aX
muss vorliegen - mindestens oder höchstens - damit sich der Reaktionsablauf
umkehrt?
Standardpotentiale: "Sn" -0,140 V; "Pb"
-0,126 V. Eo von Pb ist positiver, also findet bei "Pb"
die Reduktion statt.
Wenn aX = 1: Pb2+ oxidiert
Sn zu Sn2+ (und wird dabei zu Pb reduziert).
{Pb2+
+ Sn 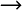 Pb + Sn2+}
Pb + Sn2+}
Für Sn ist
a = 1, also E = Eo. Damit die umgekehrte Reaktion abläuft, muss
das Potential von "Pb" so weit nach links
verschoben werden, dass
es negativer als das Potential von "Sn" wird. Eine Verschiebung nach
links ist nach der
Nernstschen Gleichung möglich, wenn a < 1. (Dann
ist log(a) < 0, also wird eine negative Zahl zu Eo addiert.)
Die
mindestens nötige Verschiebung nach links ist erreicht, wenn E("Pb") = E("Sn").
Die dann berechnete Aktivität aX
ist also die höchst
mögliche Aktivität für den verlangten "umgekehrten"
Reaktionsablauf.
E
("Pb") = Eo("Pb) + 0,0592 / 2 * log(aX): log(aX)
= {-0,140 - (-0,126) } * 2 / 0,0592 = -0,473; aX = 0,34.
Wenn
aX < 0,34 oxidiert Sn2+ Pb zu Pb2+ (und
wird dabei zu Sn reduziert).
{Sn2+ + Pb 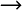 Sn + Pb2+}
Sn + Pb2+}
8) (Verständnisfrage - nach den bisherigen Beispielen
lösbar): Durch geeignete Aktivitäten wird erreicht, dass zwei
Paare
Metall | Metallion trotz verschiedenem Eo das gleiche E besitzen.
Welche Aussage zur Reaktion folgt daraus?
Bisher haben wird gesehen:
Beim edleren Paar mit dem positiveren E findet die Reduktion statt. Bei gleichem E ist dann also
keines der Paare edler. Es wird
keine Reaktion stattfinden.
Präzise drückt man das so aus:
Die Reaktion befindet sich im Gleichgewicht.
9) Verständnisfrage: Wir gehen von den Halbzelle
Cu | Cu2+ (a=1) und Zn | Zn2+ (a=1) aus.
Wie
verändern sich im Laufe der dann möglichen Reaktion die beiden Einzelpotentiale
und die EMK?
Am Anfang gelten die Standardpotentiale (+0,342 und
-0,763 V).
Dafür ist - wie inzwischen sicher sofort lösbar (!) - die
Reaktion: Cu2+ oxidiert Zn zu Zn2+.
Reaktionsgleichung:
Cu2+ + Zn 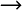 Cu + Zn2+.
Cu + Zn2+.
Die Cu2+-Aktivität nimmt also ab
und die Zn2+-Aktivität nimmt zu. Für die Potentiale E gilt
daher:
E("Cu") wird kleiner (weil a kleiner wird) und
E("Zn") wird größer.
Da nun beide Potentiale
E näher aneinander rücken, wird die Differenz der beiden kleiner:
die EMK wird kleiner.
{Allgemeinere Zusatzüberlegung: Beim Ablauf
der Reaktion wird sich schließlich als Endzustand das Gleichgewicht
einstellen.
Dafür ist die EMK = 0; die anfängliche EMK = 1,105 V muss also kleiner
werden.}