REDOXGLEICHUNGEN -
II. Oxidationszahl - Definition
|

|
DEFINITION
Oxidationszahl = Formale Ladung eines
Atoms in einer Verbindung, wenn diese aus lauter Ionen aufgebaut
wäre.
Dabei werden die Elektronen einer Bindung vollständig
dem elektronegativeren Atom zugeordnet.
Dann wird mit der Anzahl
Außenelektronen des neutralen Atoms verglichen.
|
|

|
ZWECK
Die Oxidationszahl ist eine formale Größe!
Sie
hat keine direkte physikalische Bedeutung. Sie beschreibt aber
"bequem" Redoxvorgänge!
Bei einer Oxidation
erhöht sich die Oxidationszahl. (Dies entspricht der
Abgabe von Elektronen.),
Bei einer Reduktion
erniedrigt sich die Oxidationszahl. (Dies entspricht der
Aufnahme von Elektronen.)
|
Die Bestimmung von Oxidationszahlen direkt unter Verwendung der Definition ist möglich
- aber unpraktisch!
|
|
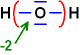
H2O
O ist elektronegativer als H und erhält
die Bindungselektronen
O: 8 Elektronen / Neutrales Atom:
6 / also Ox.-Zahl = -2
H:
0 Elektronen / Neutrales Atom: 1 / also Ox.-Zahl = +1
|
|
|
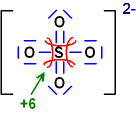
Sulfation SO42-
(eine Strichformel
angegeben)
O ist elektronegativer als S und erhält die Bindungselektronen
O:
jeweils 8 Elektronen / neutral: 6 / also Ox.-Zahl jeweils = -2
S:
0 Elektronen / neutral: 6 / also Ox.-Zahl = +6
|
|
|
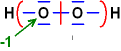
Wasserstoffperoxid H2O2
Die mittlere
Bindung verknüpft zwei Atome gleicher Elektronegativität;
jeweils
1 Elektron wird jedem Partner zugeordnet.
O: jeweils 7
Elektronen / neutral: 6 / Ox.-Zahl jeweils = -1
H:
jeweils 0 Elektronen / neutral: 1 / Ox.-Zahl jeweils = +1
|
|
|
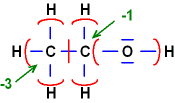
Ethanol CH3 - CH2 - OH
Elektronegativitätsreihenfolge:
O > C > H
O: Ox.-Zahl = -2
und H: Ox.-Zahl jeweils = +1
linkes
C: 7 Elektronen / neutral: 4 / Ox.-Zahl = -3
rechtes
C: 5 Elektronen / neutral: 4 / Ox.-Zahl = -1
|
Bei organischen Molekülen ist diese Methode nicht gut! Die nach den
Regeln erfolgte Ermittlung der Ox.-Zahlen macht
bei der Aufstellung von Redoxgleichungen
Schwierigkeiten; es ist dann besser mit der mittleren Oxidationszahl -2
für das C-Atom zu rechnen!
WEITER: Wesentlich bequemer und auch sinnvoller ist die Bestimmung
von Oxidationszahlen mit einigen Regeln.
![]()
![]()



