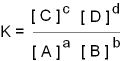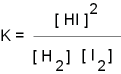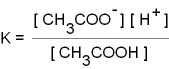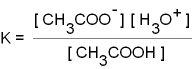|

|
Eine chemische Reaktion ist allgemein
definiert: Edukte  Produkte.
Produkte.
Oft kommt der Fall vor, dass die Reaktion nicht
nur in eine Richtung verläuft,
sondern Hin- und Rückreaktion
möglich sind, Edukte 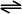 Produkte.
Produkte.
Aus Experimenten und theoretischen Überlegungen
wurde gefunden, dass sich dann nach einiger Zeit ein konstantes
Verhältnis zwischen den Konzentration der Produkte und Edukte
einstellt.
{Es laufen immer noch die Hin- und Rückreaktion
ab, die Reaktion ist also nicht zum Stillstand gekommen! Die Konzentrationen
bleiben aber im Mittel gleich.}
Man nennt diesen Zustand das
chemische Gleichgewicht.
|
Mathematisch wurde dafür die Gleichgewichtskonstante K definiert.
|
K = Konzentration der Produkte / Konzentration der Edukte
[
X ] ist dabei eine Kurzschreibweise für c(X)
|
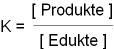
|
{Es gibt auch noch andere Definitionen für K, z.B. mit
Drücken anstelle der Konzentrationen; K für Konzentrationen ist aber
die wichtigste Form.}
Definitionsgemäß schreibt man in einer richtigen Reaktionsgleichung
die Produkte auf der rechten Seite. Damit ist für K auch eindeutig festgelegt,
was im Zähler und was im Nenner steht. Wenn in der Gleichung stöchiometrische
Koeffizienten vorkommen, werden diese als Hochzahlen in der Formel für
K eingesetzt. (Die Begründung dafür kommt aus der Theorie!). Wenn
in der Reaktionsgleichung ein Lösungsmittel im Überschuss vorkommt,
ändert sich dessen Konzentration im Verlaufe der Reaktion praktisch nicht;
die Konzentration des Lösungsmittels wird dann in K berücksichtigt.
|
Beispiel allgemeine Reaktion
a A + b B 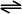 c C + d D
c C + d D
|
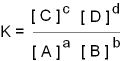
|
|
Wasserstoff und Iod bilden Iodwasserstoff
H2
+ I2  2
HI 2
HI
|
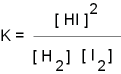
|
|
Dissoziation der Essigsäure
CH3COOH
 CH3COO-
+ H+ CH3COO-
+ H+
|
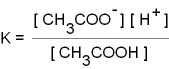
|
|
möglich ist dafür auch
CH3COOH
+ H2O  CH3COO- + H3O+
CH3COO- + H3O+
|
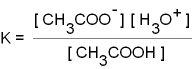
|
|
Weil [H+] = [H3O+], also nur
eine verschiedene Schreibweise für dieselbe Konzentration,
verwendet wird, sind
die beiden letzten Formeln identisch! In der zweiten Formel ist
die (konstante) Konzentration des Wassers im Wert von K enthalten.
|
Zur Anwendung der Gleichgewichtskonstante auf die Dissoziation von Säuren
siehe Downloads, Nr. 2
Hier wird
die Anwendung auf das Löslichkeitsprodukt und das Nernstsche Verteilungsgleichgewicht
besprochen.
NUR falls links der blaue Balken fehlt:
STARTSEITE
![]()
![]() Produkte.
Produkte.![]() Produkte.
Produkte.