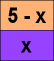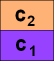|

|
Zwei nicht miteinander mischbare
Flüssigkeiten liegen vor.
Ein Stoff, der sich
in beiden Lösungsmitteln lösen kann, wird dazu gegeben.
Dann
stellt sich ein Gleichgewicht sein.
Das
Verhältnis der Konzentrationen des Stoffs in beiden Lösungsmittel
ist konstant.
Man nennt - nach dem Entdecker
- die Formel
das Nernstsche Verteilungsgleichgewicht.
|
Im Laboratorium wird dies als Ausschütteln
benutzt. Iod löst sich wesentlich besser in Chloroform (CHCl3)
als in Wasser. Wir erwarten daher, dass Iod sich nach Kontakt beider Flüssigkeiten
vor allem in der CHCl3-Lösung befinden wird.
Ausgangszustand: Iod nur im Wasser
|

|
CHCl3 wird dazu gegeben
|

|
Schütteln und Stehenlassen, damit sich die Lösungen wieder trennen.
|
Iod ist überwiegend in der CHCl3-Phase. Iod ist aus der wässrigen
Lösung "ausgeschüttelt" worden.
|

|
Allgemein verteilt sich ein Stoff zwischen zwei Phasen (Lösungsmitteln).
|
Gleichung für die Verteilung eines Stoffs
in 2 Phasen
"Nernstsches Verteilungsgleichgewicht"
|
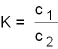
|
Aufpassen! c1 bedeutet
nicht "Konzentration des Stoffs 1" sondern "Konzentration des (zu verteilenden)
Stoffs im Lösungsmittel 1"!
- K (I2 in CHCl3 / H2O) = 120. "1"
= CHCl3, "2" = H2O.
- Die Konzentration in CHCl3 ist c1
= 480 mmol/l. Welche Konzentration c2 liegt dann
in Wasser vor?
c2 = c1 / K = 480 / 120 = 4 mmol/l.
- Falle: "Dummdrösel rechnet"
In 200 ml H2O
liegen 5 mmol I2 vor. Ausgeschüttelt wird
mit 20 ml CHCl3.
Welche Stoffmenge I2
ist nach dem Ausschütteln in der CHCl3-Phase?
c2
= 5 mmol / 200 ml = 25 mmol/l. c1 = K * c2 = 120 *
25 = 3000 mmol/l;
in 20 ml also 60 mmol. Kann das stimmen?
NEIN - aus 5 mmol können
nicht plötzlich 60 mmol werden! Also: Zwar ein
beliebter Fehler, aber trotzdem falsch!
Für Rechenübungen ist also eine Zusatzüberlegung
nötig, die nichts mit der Physik zu tun hat (diese ist durch die Nernstsche
Formel vollständig beschrieben), sondern mit der Stöchiometrie (also
dem "Fachrechnen").
|

|
|
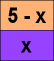
|
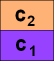
|
|
5 mmol I2 sind in H2O
|
x mmol gehen in CHCl3
|
In H2O sind noch 5 - x mmol
|
Das Verhältnis c1/c2 ist K
|
- Dann also "der verbesserte Dummdrösel": x sei die nach dem Ausschütteln im Lösungsmittel "1"
vorliegende Stoffmenge;
c1 = x / V1 und c2
= ( 5 - x ) / V2
K = { x / V1 } / { (5
- x ) / V2 } = { x / 20 } / {( 5 - x ) / 200 } = 120. Auflösung:
x / 20 = ( 5 - x ) * 120 / 200; .... ; x = 4,615 mmol
Kontrolle:
{4,615 / 20} / { (5 - 4,615 ) / 200 } = 120.
Weitere Anmerkung für Rechenaufgaben:
Anstelle
der Stoffmengen können direkt die Massen in die Nernstsche Formel
eingesetzt werden!
Es gilt: c = n / V (Stoffmengenkonzentration);
β = m / V (Massenkonzentration); n = m / M (Stoffmenge)
Weil
im Bruch c1 / c2 im Nenner und Zähler dieselbe Substanz
vorkommt, kürzt sich M und c1 / c2 = β1
/β2.
Als Einheiten können für m "g, kg, mg, ..."
verwendet werden.
Wichtig ist nur, dass in Zähler und Nenner dieselben
Einheiten benutzt werden.
Ebenso kann für V "l, ml, ..." verwendet
werden.
- 70 mg I2 befinden sich in 30 ml CHCl3.
Welche
Masse I2 ist nach dem Ausschütteln
mit 500 ml H2O in der wässrigen Phase?
x
ist die nach der Verteilung in der wässrigen Phase vorhandene Menge
Iod.
"1" = CHCl3; "2" = H2O;
damit gesamte Menge mG = 70 mg; m1 = mG
- x; m2 = x.
K
= { ( 70 - x ) / 30 } / { x / 500 } = 120; 120 * x / 500 = ( 70 - x ) /
30; ... ; x = 8,537 mg
Kontrolle: { ( 70 - 8,537 ) / 30 } / {
8,537 / 500 } = 120.
- Zu 50 ml CHCl3 und 250 ml H2O werden 80 mg I2 dazugegeben.
Wieviel mg sind
nach der Verteilung in jeder der beiden Phasen?
"1" = CHCl3;
"2" = H2O; m1 + m2
= mG = 80. Schreiben wir x für m1, dann
ist m2 = 80 - x.
Das Verteilungsgleichgewicht ist K = 120
= { m1 / V1 } / {m2 / V2 } =
{ x / 50 } / { ( 80 - x ) / 250 }
x / 50 = 120 * (80 - x ) / 250; ...
; x = 76,8.
In CHCl3 76,8 mg und in H2O
3,2 mg.
Kontrolle: { 76,8 / 50 } / { 3,2 / 250 } = 120.
Eine
allgemeinere Formel und die mehrfache Extraktion im Übungsteil!
WEITER: Übungen zum Verteilungsgleichgewicht
![]()