Kovalente Bindung - Überlappung von
Orbitalen
|

|
Ausgehend von der VB-Theorie ("Valence Bond") kann
die Bindung qualitativ erklärt werden: Die Orbitale der Atome
überlappen sich, und diese Überlappung führt zu einem
Energiegewinn. In den Strichformeln entspricht einer solchen Überlappung
der Bindungstrich. Mit den aus der Atomtheorie bekannten Atomorbitalen
(AO) lassen sich nicht alle experimentell bekannten Geometrien beschreiben.
Dann bildet man an einem Atom Kombinationen der AO; die so entstehenden
Hybridorbitale können dann mit Orbitalen des Nachbaratoms überlappen.
In den Strichformeln wird auch dafür ein Bindungsstrich geschrieben.
Wir betrachten hier s- und p-Orbitale und Hybridorbitale dazu. (Unter
Verwendung von d-Orbitalen lassen sich noch viele andere als die
hier besprochenen Geometrien von Molekülen beschreiben.)
|
|

|
Zur Einführung
sehen wir uns das Wasserstoffmolekül H2
an. Mit Strichformeln schreiben wir: H - H.
Im H-Atom liegt ein 1s-Orbital
vor, dafür kann (im Modell von Schrödinger) eine Kugel um den Atomkern
gezeichnet werden.
|
|
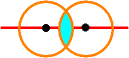
Wenn sich 2 1s-Orbitale nähern, entsteht in der Mitte eine Überlappungszone.
(Räumlich
ist das eine Schnittfigur -
wie der Raum zwischen zwei
übereinander gelegten Uhrgläsern.)
|
|
|
Die
Überlappungszone liegt in der Kernverbindungslinie,
man nennt dann die so entstehende Bindung eine s-Bindung.
(Ähnlich
wie s-, p- d- usw. die Form eines AO beschreiben, beschreiben die
griechischen Buchstaben die Form der Überlappung.)
Insgesamt gehören die 2 Elektronen der H-Atome nun beiden
gemeinsam.
(In der Überlappungszone ist die
Aufenthaltswahrscheinlichkeit am größten.)
2
Elektronen halten die beiden Atome zusammen, es liegt eine Elektronenpaarbindung
vor.
Dafür wird in der Formelschreibweise der Bindungsstrich
geschrieben.
|
|
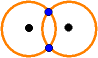
Im alten "primitiven" Bild gehören die
Elektronen zu beiden Bahnen.
(Die Zeichnung zeigt,
dass das alte Bild die Überlappung
auch schon "primitiv"
enthalten hat.)
|
|

|
Welche weiteren Überlappungsmöglichkeiten mit s-
und p-Atomorbitalen gibt es?
(zweidimensional
skizziert)
|
|
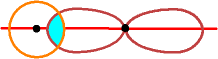
s mit p
Die Überlappung führt zu einer s-Bindung,
weil die Überlappungszone in der Kernverbindungslinie liegt.
|
|
|
p mit p - 1. Möglichkeit
Wieder eine s-Bindung
|

|
|
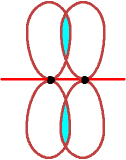
p mit p - 2. Möglichkeit
Die Überlappung
(2 Teilzonen) findet außerhalb der Kernverbindungslinie statt.
Dies nennt man eine p-Bindung.
|
|

|
Die eingeführte
Nomenklatur gilt allgemein - also auch für die später eingeführten
Hybrid-Atomorbitale.
s bedeutet eine Überlappung
in der Kernverbindungslinie und
p eine Überlappung
außerhalb der Kernverbindungslinie (1 Überlappung mit 2 Teilzonen).
|
 Warum
gibt es keine weiteren Überlappungsmöglichkeiten?
Warum
gibt es keine weiteren Überlappungsmöglichkeiten?
Die
Antwort darauf ist ein wenig schwieriger! Bisher haben wir nicht berücksichtigt,
dass Orbitale einer Funktion entsprechen, die auch ein Vorzeichen
hat. Bei einer Überlappung bilden wir das Produkt beider Funktionen, also
auch das Produkt der Vorzeichen. Wenn mehrere Teilzonen vorliegen, müssen
die Überlappungszonen unter Berücksichtigung des Vorzeichens addiert
werden. Dabei kann der Fall auftreten, dass sich die Teilflächen - gleicher
Betrag aber verschiedenes Vorzeichen - kürzen.
(Mathematisch entspricht
die Flächenbildung einer Integration.)
WICHTIG: Diese Vorzeichen
nicht mit der Ladung verwechseln!
Wir konstruieren nun 2 Situationen, die scheinbar eine Überlappung
liefern, aber bei denen sich die Teilzonen unter Berücksichtigung
der Vorzeichen kürzen. Insgesamt entsteht damit kein Energiegewinn;
also führt dies auch nicht zu einer Bindung!
|
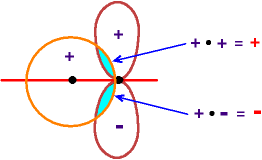
s mit p
"2. Möglichkeit"
|
|
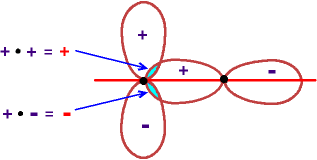
p mit p
"3. Möglichkeit"
|
|
|
Die beiden Teilzonen der Überlappung
haben jeweils gleiche Fläche aber verschiedenes Vorzeichen,
insgesamt
entsteht so keine Überlappung.
|
WEITER: Hybridisierung
NUR falls links der blaue Balken fehlt: STARTSEITE





