Einfachbindungen, die von einem C-Atom
ausgehen:
Der 1. Fall ist die Bindung zu einem H-Atom, z.B. in CH4 (Methan)
Bei
den Hybridorbitalen ist jeweils nur die größere Hälfte gezeichnet.
|
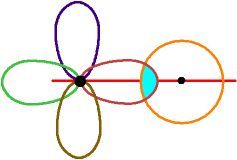
Eine Überlappung für eine der vier C - H - Bindungen
ist gezeichnet.
Das sp3-Orbital des C-Atoms überlappt
mit den s-Orbital des H-Atoms
Die Überlappungszone
liegt in der Kernverbindungslinie.
Dies ist eine σ-Bindung.
Die
4 C - H - Bindungen sind räumlich in Richtung von Ecken eines
Tetraeders um das zentrale C-Atom angeordnet.
|
|
Wie entsteht dann die Bindung im Molekül?
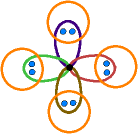
Jedes
der vier sp3-Orbitale des C-Atoms ist mit 1 Elektron besetzt. H liefert
jeweils 1 Elektron.
|
Damit sind für jedes Paar der sich überlappenden
Orbitale 2 Elektronen vorhanden; es bildet sich eine "Elektronen-Paar-Bindung".
|
|
In den Strichformeln wird ein Elektronenpaar durch
einen Bindungsstrich symbolisiert.
|
|
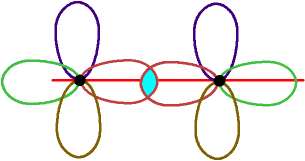
Der 2. Fall ist die Bindung zu einem anderen C-Atom, z.B. in H3C
- CH3 (Ethan)
|
Zwei sp3-Orbitale der beiden C-Atome überlappen.
Die
Überlappungszone liegt in der Kernverbindungslinie.
Auch
dies ist eine σ-Bindung.
Nur
die Überlappung zwischen den C ist gezeichnet,
die Überlappung
zu den H-Atomen ist nicht mehr gezeichnet.
Insgesamt
liegen 7 σ-Bindungen vor: 1 σ-Bindung
C - C in der Mitte, und zweimal 3 σ-Bindungen
C - H an beiden C-Atomen. Alle Bindungen sind tetraedrisch um die
beiden C-Atome angeordnet.
|
|
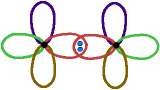
Im Molekül:
Die Bindung zu den H-Atomen ist gleichartig wie bei CH4.
|
Zwischen den beiden C-Atomen überlappen zwei mit je 1 Elektron besetzte
sp3-Orbitale.
Es entsteht auch hier eine Elektronenpaarbindung.
|
|
In den Strichformeln dafür wieder ein Bindungsstrich.
|
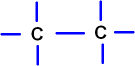
|
In den Strichformeln ist nur zu sehen, dass eine Einfachbindung vorliegt.
Aus der Theorie der Überlappung wissen wir, dass damit wegen der Überlappungszone
in der Kernverbindungslinie eine σ-Bindung vorliegt.
Die Details werden in der Strichformel nicht erkennbar. Einmal liegt eine Überlappung
1s (von H) mit sp3 (von C) und einmal eine Überlappung zwischen
sp3 (von C) mit sp3 (des Nachbar-C) vor.
Bei Bindungen zu Heteroatomen C - O und C - N liegt die gleiche Bindungsart
wie bei C - C - Bindungen vor.
Zur Beschreibung der Bindungsverhältnisse im Molekül ist auch die
Frage der Drehbarkeit um die Bindungen von Interesse. Wenn Sie sich die obigen
Zeichnungen räumlich vorstellen - s-Orbitale werden zu Kugeln und sp3-Orbitale
zu Keulen um die Bindungsachse - sehen Sie, dass eine Drehung nichts an der
Überlappungszone ändert. Bei Einfachbindungen
besteht eine freie Drehbarkeit.
WEITER: Doppelbindung
am C-Atom ZURÜCK: Anfang
"Kovalente Bindung"