HYBRIDISIERUNG AM C-ATOM
|

|
Mit sp-, sp2- und sp3-Orbitalen lassen
sich die Geometrien und Bindungsverhältnisse von C-Verbindungen
erklären.
"Schwierigkeiten" bereitet im ersten
Moment der Fall sp3, da das C-Atom keine mit drei mit
Elektronen besetzten Orbitale besitzt. Es zeigt sich aber auch,
dass auch die sp- und sp2-Hybridorbitale die richtigen Bindungsverhältnisse beschreiben.
|
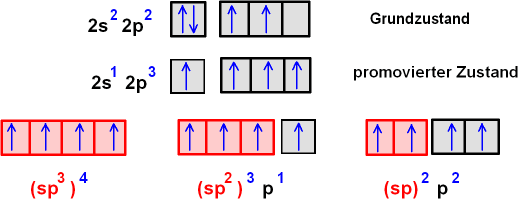
Ausgehend vom Grundzustand des C-Atoms 1s2 2s2 2p2
wird ein angeregter Zwischenzustand 1s2 2s1 2p3
erzeugt. Man nennt diesen Zustand den "promovierten Zustand" und die
dazu benötigte Energie die "Promotionsenergie". Ausgehend von
diesem promovierten Zustand werden die 2s- und 2p-Orbitale geeignet kombiniert.
Durch Bindung der dadurch entstehenden Hybridorbitale zu Nachbaratomen entsteht
ein Energiegewinn, größer als die Promotionsenergie. Insgesamt bildet
sich unter Energiegewinn das Molekül.
 Bitte nicht
verwechseln! Die "Promotion" ist ein Gedankenmodell! Der promovierte
Zustand ist keine Realität, sondern nur unser - "wir dummen Menschen"
- Hilfsmittel, um das zu beschreiben, was in der Natur geschieht. (Es
gibt außerdem auch andere Theorien zur chemischen Bindung, die auf dieses
Kozept verzichten.)
Bitte nicht
verwechseln! Die "Promotion" ist ein Gedankenmodell! Der promovierte
Zustand ist keine Realität, sondern nur unser - "wir dummen Menschen"
- Hilfsmittel, um das zu beschreiben, was in der Natur geschieht. (Es
gibt außerdem auch andere Theorien zur chemischen Bindung, die auf dieses
Kozept verzichten.)
Durch geeignete Kombinationen entstehen die drei
gewünschten Hybridorbitale. Diese sind jeweils mit
1 Elektron besetzt, können also mit 1 Elektron eines Nachbarorbitals Elektronenpaarbindungen
bilden.
- Für sp3
ist die Situation klar: Nur nach der Promotion sind vier Orbitale mit einem
Elektron besetzt und können Bindungen zu Nachbaratomen eingehen.
- Bei
sp2 wäre auch ohne Promotion die Hybridisierung möglich.
Dann bliebe aber ein 2s-Orbital übrig, während nach der Promotion
ein einfach besetztes 2p-Orbital übrig bleibt. Nur mit einem weiteren p-Orbital lassen sich
die Bindungen in realen Molekülen richtig erklären.
- Gleiches gilt
für sp: ein ohne Promotion übrig bleibendes s-Orbital kann
die Realität nicht erklären.
Die drei Hybridisierungsarten bilden die drei für C-Atome möglichen
Bindungsarten:
|
|
sp3
|
führt zu Einfachbindungen
|
|
|
sp2
|
führt zu Doppelbindungen
|
|
|
sp
|
führt zu Dreifachbindungen
|
Dabei betrachtet man nur die Elektronen der Valenzschale
(2s und 2p),
die beiden Elektronen der inneren Schale 1s2 tragen nicht zur Bindung bei.
WEITER:
Einfachbindung am C-Atom ZURÜCK:
Anfang "Kovalente Bindung"
![]()
