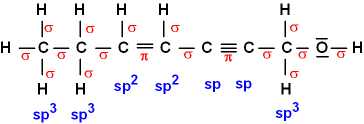LÖSUNGEN - "Kovalente Bindung"
A
- Mit der Hybridisierung kann man die tatsächlich in der Natur vorkommenden
Bindungsverhältnisse beschreiben. Vor allem die Geometrie vieler Moleküle
(Tetraderwinkel und 120° bei Doppelbindungen) kann ohne Hybridisierung
nicht erklärt werden! Erst mit der Hybridisierung ist der Aufbau von
Doppel- und Dreifachbindungen verständlich.
- Um die richtigen Kombinationen der Atomorbitale zu bilden und dann diese
mit jeweils 1 Elektron zu besetzen, ist die "Promotion" am C-Atom
nötig. Dabei wird ausgehend vom Grundzustand ein gedachter (keine realer!)
angeregter (also Zustand höherer Energie) Zwischenzustand angenommen,
von dem aus die Hybridisierung abgeleitet wird. Jedes der dann besetzen
Orbitale bildet mit Elektronen des Partner Elektronen-Paar-Bindungen. Für
die Bildung des promovierten Zustands ist eine Energie nötig, die Bildung
des Moleküls liefert einen größeren Energiegewinn.
- Mathematisch werden Summen bzw. Differenzen der Atomorbitale gebildet.
Wie diese linearen Gleichungen aussehen, hat Linus Pauling erforscht. Die
Hybridorbitale sind immer noch Atomorbitale; sie werden aber erst zur Erklärung
der chemischen Bindung eingeführt und nicht schon zur Erklärung
des Atombaus. Weil Elektronen nicht verschwinden oder aus dem Nichts erzeugt
werden können, gibt es immer gleichviele kombinierte Hybridorbitale
wie Atomorbitale zur Hybridisierung benutzt wurden. Hybridorbitale zeigen
räumlich in andere Richtungen als die zugrunde gelegten Atomorbitale.
Wegen der größeren Ausdehnung in einer Richtung (Form der Doppelkeule
beachten!) ist eine besssere Überlappung mit Nachbarorbitalen möglich.
- Nur bei der Doppelbindung.
- Freie Drehbarkeit besteht dann, wenn die Drehung nichts an der Überlappung
ändert. Die Überlappung ist der Grund, dass sich eine kovalente
Bindung ausbildet. Bei einer C - C - Bindung liegt die Überlappungszone
in der Kernverbindungslinie, es kann also um diese Linie herum gedreht werden.
Anders als bei dieser s-Bindung enthält
die C = C - Doppelbindung auch eine p-Bindung.
Dabei überlappen die p-Orbitale in 2 Teilzonen außerhalb der
Kernverbindungslinie. Eine Drehung würde diese Überlappung
aufheben. Dieser Bruch der p-Bindung ist nur durch Energiezufuhr möglich.
----
Zurück zum Aufgabentext
- Nein - nur 1 Überlappung. Zum Verständnis: 1 p-Orbital hat
auch 2 Hälften. Ebenso tritt bei der Seite an Seite Überlappung
diese an 2 Hälften auf, insgesamt ist es nur 1 Überlappung der zwei
Orbitale.
- H mit H: H besitzt nur das 1s-Orbital. Dieses kann mit einem weiteren H überlappen:
1 s - s.
C benutzt in Bindungen die Hybridorbitale.
C
mit H: Überlappung mit einem s-Orbital von H, für eine
CH-Bindung: 2
sp3 - s (an einer Einfachbindung);
3
sp2 - s (an einer Doppelbindung); 4
sp - s (an einer Dreifachbindung).
C mit C: 5
sp3 - sp3 (Einfachbindung); 6
sp3 - sp2 (Einfachbindung an einer Doppelbindung);
7
sp3 - sp (Einfachbindung an einer Dreifachbindung); 8
sp2 - sp (Doppelbindung an einer Dreifachbindung).
Zu einer
s-Bindung mit einer zusätzlichen
p-Bindung
führen: a
sp2 - sp2 (Doppelbindung); b
sp - sp (Dreifachbindung);
- Aus der Herleitung der Hybridorbitale ist zu sehen: p-Atomorbitale für
p-Bindungen bleiben übrig neben sp2-
oder sp-Hybridorbitalen. Eine p-Bindung kommt
in Doppel- und Dreifachbindungen vor, muss darum stets zusätzlich die
s-Bindung enthalten.
- Sehen Sie sich die Beispiele an!
Eine nicht mögliche Überlappung enthält mehrere Zonen, die
sich wegen der Vorzeichen (Produkte der Vorzeichen der Orbitale bzw. Teile
davon bei p-Orbitalen) kürzen.
- Weder Ladungen noch Teilladungen! Das sind die Vorzeichen der Funktion!
Natürlich kann man sich das bei dreidimensionalen Funktionen nicht
mehr gut vorstellen! Vergleichen Sie die eindimensionale Erklärung:
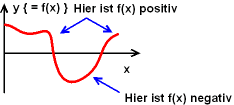
----
Zurück zum Aufgabentext
- Prinzipiell wäre das möglich, da in der Valenzschale 2s2
2p2 die benötigten Elektronen für die einfache Besetzung
der Orbitale vom Typ sp2 vorhanden sind. Übrig bleibt aber
dann ein 2s-Orbital. Das ist im Widerspruch zur Erfahrung, dass die sp2-Hybridisierung
in Doppelbindungen vorkommt, man also als übrigbleibendes Orbital ein
besetztes p-Orbital benötigt. Falsch wird also die weitere Aussage
zur möglichen Bindung des C-Atoms.
- Bindungen werden durch Elektronen in der Valenzschale erklärt.
Die Hybridisierung verändert nur den Charakter dieser an der Bindung
beteiligten Valenzelektronen. Die 1s-Elektronen der inneren Schale haben
damit nichts zu tun.
- Korrekte Bindungswinkel wären 109,5° (Einfachbindungen, räumliche
Tetraederanordnung ), 120° (Doppelbindung, eben) und 180° (Dreifachbindung,
linear). Es ist üblich, dafür vereinfacht linear zu zeichnen.
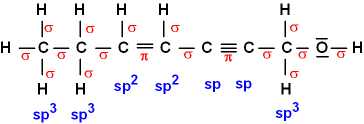
- Wieder linear gezeichnet:
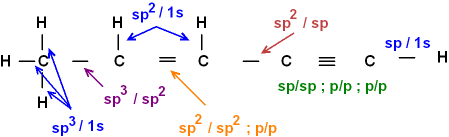
----
Zurück zum Aufgabentext
B
- Aus dem Aufgabentext ist ersichtlich: Hybridisierung kommt vor. Aus
der üblichen Strichformel ist bekannt: es liegen Einfachbindungen vor.
Damit kommt nur sp3 in Betracht. Für den Grundzustand ist
die Valenzschale von O: 2s2 2p4. Wie bei C "promovieren"
wir zum angeregten Zustand 2s1 2p5. Nach Bildung von
4 sp3-Orbitalen haben diese folgende Besetzung: 2, 2, 1, 1. Die
beiden einfach besetzten Orbitale bilden nach der Überlappung mit den
1s-Orbitalen von H zwei Einfachbindungen (Elektronenpaarbindung). Übrig
bleiben zwei mit 2 Elektronen besetzte sp3-Orbitale. In den Strichformeln
werden diese "freien" Elektronenpaare am O dazu gezeichnet.

----
Zurück zum Aufgabentext
- Wenn NH3 ein ebenes Molekül wäre, kommt nur ein
symmetrisches Dreieck in Betracht. Wegen der Bindungswinkel 120° wäre
dann eine sp2-Hybridisierung nötig. Der Grundzustand von
N ist in der Valenzschale 2s2 2p3. Nach der Promotion
zu 2s1 2p4 und der Hybridisierung folgen drei einfach
besetzte sp2-Orbitale (für die s-Bindung zu den H-Atomen)
und ein doppelt besetztes p-Orbital (als freies Orbital). Aber offenkundig
will die Natur dieses nicht, auch wenn wir "so schön theoretisch
herumgespielt haben"!
Für eine nicht ebene Struktur von NH3
ist sp-Hybridisierung unmöglich, da damit nur lineare Moleküle
erzeugt werden können, also muss es sp3 sein. Ausgehend
von promovierten Zustand 2s1 2p4 erhalten wir vier
sp3-Orbitale mit der Besetzung: 2, 1, 1, 1. Die drei einfach besetzten Orbitale
bilden durch die Überlappung mit dem 1s-Orbital von H drei s-Bindungen,
das doppelt besetzte sp3-Orbital bleibt als freies Elektronenpaar
übrig.

----
Zurück zum Aufgabentext
- Tetraederstruktur weist auf sp3-Hybridisierung hin. Da ein
Kation 1 Elektron weniger hat, ist die Besetzung der vier sp3-Orbitale:
1, 1, 1, 1. Diese Orbitale überlappen jeweils mit 1s-Orbitalen von
H unter Bildung von s-Elektronenpaarbindungen.
- Da sich Methylamin H3C-NH2 laut Aufgabenstellung
von NH3 ableitet, muss am N dieselbe Situation vorliegen, also
sp3-Hybridisierung. Eine der Überlappungen ist nun nicht
mehr sp3 (N) - 1s (H) sondern sp3 (N) - sp3
(C der CH3-Gruppe).
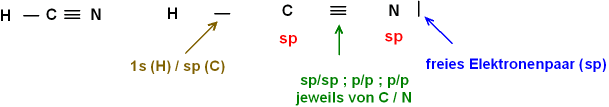
- Für ein lineares Molekül ist sp-Hybridisierung nötig.
Also (Schritt für Schritt - jeweils für die Valenzschale von C
und N):
Am C: Grundzustand: s2 p2; promoviert: s1 p3; hybridisiert: 2 sp-Orbitale
mit je 1 Elektron; 2 p-Orbitale mit je 1 Elektron
Am N: Grundzustand:
s2 p3; promoviert: s1 p4; hybridisiert:1 sp-Orbital mit 1 Elektron; 1 sp-Orbital
mit 2 Elektronen; 2 p-Orbitale mit je 1 Elektron.
Nun die Bindung:
Von
C aus: 1 sp (von C) überlappt mit 1s (von H); 1 sp (von C) überlappt mit 1 sp (von
N);
die 2 p-Orbitale (von C) überlappen mit den 2 p-Orbitalen (von N) und vervollständigen
die Dreifachbindung zum N
Von N aus: 1 sp (von N) und 2 p (von N) für die Bindung
zum C, übrig bleibt ein doppelt besetztes sp-Orbital am N als freies
Elektronenpaar.
----
Zurück zum Aufgabentext
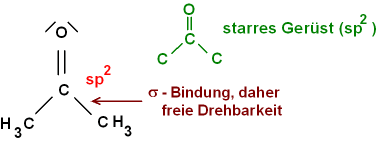
- Die Doppelbindung am CO bedingt eine sp2-Hybridisierung.
Damit ist das Gerüst C - CO - C starr. Die CH3-Gruppen sind
frei drehbar, weil sie über eine s-Bindung (Überlappung von sp3
der Methylgruppe mit sp2 am C=O) an C=O gebunden sind.
----
Zurück zum Aufgabentext
ZURÜCK:
Anfang "Kovalente Bindung"