Grundprinzipien der Thermodynamik (für chemische
Reaktionen)
|

|
Das Schöne an dieser Theorie:
Eine allgemeine Theorie zum Ablauf chemischer Reaktionen
Das
Schwere an dieser Theorie: Abstrakt, wenig anschaulich, "gewöhnungsbedürftig".
Zwei
wichtige Aussagen sollen hergeleitet werden:
A) Tritt bei chemischen
Reaktionen Wärme auf?
B) Ist eine chemische Reaktion überhaupt
möglich?
Beide Fragen sollen theoretisch geklärt werden.
|
|

|
Motto:
Es ist besser, vorher zu überlegen,
anstatt nach einer Explosion festzustellen,
dass ein nicht erwarteter
Ablauf eingetreten ist.
Es ist besser, vorher zu überlegen,
anstatt monatelang eine Reaktion experimentell
zu erforschen
und dann festzustellen, dass die Reaktion gar nicht möglich
ist.
|
|

|
Wegen der ungewohnten Fachsprache
sollte man dieses Kapitel Thermodynamik
zuerst einmal schnell durchlesen und erst
dann eingehender studieren!
|
1. Erfahrung und Ziel der Theorie
|
Experimentell wird bei Reaktion oft ein Wärmeumsatz beobachtet
|
|
C + O2
|
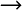
|
Feuer mit Wärmeentwicklung beim Verbrennen von Kohle
|
|
H2O + H2SO4
|
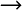
|
Erwärmung bei Mischen von Wasser und konzentrierter Schwefelsäure
|
|
NH4Cl (fest) + H2O
|
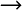
|
Beim Auflösen des Salzes in Wasser wird eine Abkühlung
beobachtet
|
Ziele einer quantitativen Beschreibung waren (geschichtlich auch nacheinander
erarbeitet):
1. Zahlen finden, deren Kombination berechnen lässt, welcher
Wärmeumsatz erfolgt,
2. Zahlen finden, die eine Aussage liefern, ob
die Reaktion überhaupt möglich ist.
Der Begriff des "Systems"
Als "System" bezeichnet man den Teil der
Welt, der für den Vorgang wichtig ist. Der Rest der Welt ist
die "Umgebung". Das klingt abstrakt, ist aber gar nicht so schwer
- sagen zumindest die Physiker! Also ist ein Beispiel nötig:
Bleiben
wir bei der Verbrennung von Kohle, C + O2 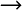 CO2. C und O2 reagieren miteinander und bilden das Gas
CO2.
CO2. C und O2 reagieren miteinander und bilden das Gas
CO2.
Diese 3 Stoffe sind am Reaktionsgeschehen beteiligt. Diese 3
Stoffe nennen wir das System.
Als Folge der Reaktion setzen die Stoffe Wärme
frei.
Wir, in der Umgebung, empfangen diese Wärme. (... und freuen uns
darüber an kalten Wintertagen)
|
Drei Arten eines Systems sind in der
Beschreibung wichtig:
|
|
1.
|
In einem abgeschlossenen
System (isolierten) System ist
kein Materie- und kein Energieaustausch
möglich.
(Beispiel: Die Reaktion wird in einer geschlossenen "Thermoskanne"
durchgeführt. Die Stoffe sind "eingesperrt" und die Isolierung
der Thermoskanne verhindert auch, das Wärme hinein oder heraus kann.)
|
|
|
|
|
2.
|
In einem geschlossenen System ist
nur Energie-
aber kein Materieaustausch möglich.
(Beispiel: Ein verschlossenes Glasgefäß
kann Wärme aber keine Stoffe durchlassen.)
|

|
|
|
|
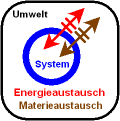
3.
|
In einem offenen
System sind
Materie- und Energieaustausch möglich.
(Dies ist
sicher der für die Praxis wichtigste Fall! Wir Menschen sind zum Beispiel
ein offenes System, da wir Wärme und Stoffe mit der Umgebung austauschen.)
|

|
WEITER: Zustandsgrößen
NUR falls links der blaue Balken fehlt: STARTSEITE
![]()
![]()
![]()


