3. Bildungsenthalpie
|

|
Für Anwendungen der Thermodynamik
auf chemische Reaktionen wird der Energieinhalt von Stoffen durch
die Bildungsenthalpie definiert. Der Bezugspunkt sind die
Elemente. Sie erhalten den Enthalpiewert 0. Verbindungen sind Reaktionsprodukte
aus den Elementen.
Die Bildungsenthalpie einer Verbindung ist gleich
der Enthalpieänderung für eine (gedachte) Reaktion "Bildung
einer Verbindung aus den Elementen".
(Damit
hat auch jedes Element die Bildungsenthalpie 0. "Aus einem
Element entsteht ein Element" ist keine Reaktion, die etwas
an den Energien ändert.)
|
|

|
Diese Definition ist ein weiteres
sehr wichtiges Konzept der Theorie!
Frage:
Welche Energie steckt in einem Stoff?
Als Menschen des 21.
Jahrhunderts sehen wir das Dilemma: Das hängt vom Standpunkt
ab! Derzeit können wir die Energie in Stoffen bis auf geringe
Ausnahmen nur durch chemische Reaktionen gewinnen. Vielleicht gelingt
es uns einmal, durch Kernfusion wesentlich mehr Energie aus einem
Stoff zu gewinnen. Vielleicht entdecken wir eine neue derzeit noch
unbekannte Energieform. Die gewählte Definition passt genau
zu unserem derzeitigen Wissen über die Chemie: Elemente sind
die Grundstoffe und Verbindungen sind aus diesen aufgebaut. Ändert
sich unser Wissen, muss nur der Bezugspunkt neu definiert werden,
aber alles andere an der Theorie bleibt ungeändert gültig!
|
Beispiel: Bei der Verbrennung von
Kohlenstoff zu Kohlendioxid wird eine Enthalpieänderung ΔH
= - 394 kJ / mol gemessen. CO2 wird so aus den Elementen erzeugt,
die Verbrennung ist genau die Bildungsreaktion von CO2. Die Bildungsenthalpie
von CO2 ist daher: ΔHB(CO2)
= - 394 kJ / mol.
|
Verständnis-Übung:
Formulieren
Sie eine Antwort!
Warum ist die Bildungenthalpie
ΔHB(Fe)
= 0?
{Nur mit der Maus über "Antwort"
fahren!
Klicken ist nicht nötig!}

|

|
In Tabellen findet man die experimentell ermittelten Werte ΔHB
chemischer Verbindungen. Mit diesen Tabellenwerten lässt sich die
Reaktionsenthalpie beliebiger Reaktion ΔHR
einfach berechnen: Enthalpieänderung bei einer Reaktion = Summe der Bildungsenthalpien
der Produkte - Summe der Bildungsenthalpien der Edukte; dabei müssen die
stöchiometrischen Koeffizienten der Reaktionsgleichung berücksichtigt
werden.
|
ΔHR (Reaktion)
= Σ{ΔHB
(Produkte) } - Σ
{ ΔHB (Edukte) }
|
Beispiel: Verbrennung von Methan zu CO2;
Reaktionsgleichung CH4 + 2 O2 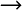 CO2 + 2 H2O
CO2 + 2 H2O
Bekannte Tabellenwerte
- Bildungsenthalpien in kJ / mol:
ΔHB(CH4) = -75 ; ΔHB(CO2) = -394 ;
ΔHB(H2O, flüss.) = - 286
ΔHB(O2) = 0 (weil
O2 ein Element ist!)
ΔHR
= {ΔHB(CO2) + 2 * ΔHB(H2O)
}- {ΔHB(CH4)
+ 2 * ΔHB(O2) }
= { (-394)
+ 2 * (-286) } - { (-75) + 0 } = -891 kJ / mol.
CH4 kann daher in einer exothermen Reaktion zu
CO2 verbrennen.
Wir haben auch berechnet, wieviel Wärme bei
der Verbrennung von 1 mol CH4 frei wird.
(891 kJ bei der Verbrennung
von 1 mol)
Für die Bearbeitung des nächsten
- wichtigsten (!) - Kapitels sind keine zusätzlichen
Übungen nötig!
Hauptanliegen ist die
Klärung der Frage, wie entschieden werden kann, ob eine Reaktion ablaufen
kann; dies ist Inhalt des nächsten Kapitels.
|
Wenn Sie trotzdem wollen:
Weitere Beispiele dazu
|

|
|
Zusatzinformation (ein wenig schwieriger!)
Lassen sich die Werte auch auf andere Bedingungen
umrechnen?
Bei einer Verbrennung haben wir sicher mehr als 25 °C!
|

|
WEITER: Entropie
und Freie Enthalpie
![]()
![]()
