Die Thermodynamik beschreibt als Theorie die makroskopische Welt, unsere
Erfahrungen. Eine Erfahrung ist ganz einfach, "aus Nichts kommt Nichts".
Dieses wollen wir etwas vertiefen. Dabei lernen wir eine typische Denkweise
dieser Theorie kennen. Die Argumente sind abstrakt, aber stets wird Bezug genommen
auf die von uns Menschen durch die Sinne erfahrbare Natur.
|
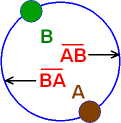
Wir betrachten ein System mit 2 Zuständen
A und B. Wir nehmen an, dass man von A nach B auf einem
Weg kommt, der reversibel (umkehrbar) ist. Von B nach A kann man
dann auf demselben Weg zurückkommen. Es soll aber auch ein
zweiter Weg von B nach A existieren. Die Zustände A und B haben
verschiedene Energie, wir verwenden dafür die Zustandsfunktion
H.
|
|
|
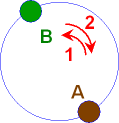
Wir gehen zuerst von A nach B und dann von
B nach A auf demselben Weg zurück.
Wenn für
den 1. Weg Energie aufwenden müssen, gewinnen wir genau dieselbe
Energie beim 2. Weg wieder zurück. Das ist plausibel - weil
wir von der "Energieerhaltung" gehört haben. Alle
experimentellen Untersuchungen haben das bestätigt.
{Mit
geeigneten Geräten könnten wir messen: Die Energie, die
benötigt wird, um 1 Liter Wasser von 20 °C auf 80 °C
zu erwärmen, bekommen wir zurück, wenn sich das Wasser
wieder auf 20 °C abkühlt. Wir müssen nur durch eine
"Thermoskanne" dafür sorgen, dass keine Wärme
verloren geht. In der Fachsprache: ein "abgeschlossenes"
System.}
|
|
|
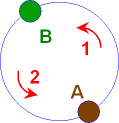
Wir gehen von A nach B, für den Rückweg
nehmen wir den 2. Weg.
Dieser 2. Weg soll weniger
Energie als der 1. Weg benötigen.
Was ist dann die Folge:
Für den Weg von A nach B wurde dem System eine bestimmte Energie
ΔH(1) zugeführt, für den Rückweg
entnehmen wir dem System eine geringere Energie ΔH(2)
< ΔH(1). Das System ist wieder im
Ausgangszustand, hat aber größere Energie!
|
|
Der letzte Fall ist sehr interessant: Wir bewegen uns vorwärts und wieder
zurück und gewinnen bei jeder Wanderung Energie - aus nichts (!!!). Dies
können wir beliebig oft wiederholen und wir haben ein "Perpetuum
mobile" (lateinisch "sich ewig bewegend"). Die menschliche
Erfahrung ist: Alle Versuche, eine solche Maschine zu konstruieren,
sind gescheitert! Wir können zwar Energien umwandeln, aber nie aus nichts
neu erzeugen.
Weil ein "Perpetuum Mobile" unmöglich ist, muss auf jedem
Weg zwischen zwei Zuständen die gleiche Differenz ΔH
gelten. ΔH hängt damit nicht
vom Weg, sondern nur vom Ausgangs- und Endzustand ab. Es gilt eindeutig:
ΔH
= H(Endzustand) - H(Anfangszustand)
Eine alternative Formulierung
ist: Es gibt nach der Erfahrung Größen, deren Differenzen nur von
den Zuständen und nicht vom Weg zwischen den Zuständen abhängen.
Solche Größen nennen wir eine Zustandsfunktion.
{Aus der Verbrennung oder aus Wasserkraft entsteht Strom; mit Strom können
wir heizen oder Licht erzeugen. Ein Kraftwerk, das auf der grünen Wiese
steht und uns Strom liefert, ohne dass dort irgendetwas verbraucht wird, wäre
schön wurde aber noch nicht erfunden. Die Thermodynamik sagt, dass es auch
nie erfunden wird! Man nennt diesen Erfahrungssatz auch
den "1. Hauptsatz der Thermodynamik". Offenkundig ist er
nur eine andere Formulierung des bekannten
Naturgesetzes der "Energieerhaltung".}
|

|
Warnungen:
|
|
1.
|
Bei der Anwendung auf reale Experimente muss beachtet
werden, dass die Systeme meistens nicht abgeschlossen sind.
Bei
einer Erwärmung geht in der Regel ein Teil der Wärme auch
in die Umgebung.
{Vergleich: bei mechanischen
Vorgängen haben wir die Reibung. Im Vakuum würden eine
Feder und eine Bleikugel gleich schnell zu Boden fallen.
In Luft
... probieren sie es selbst aus!}
|
|
2.
|
Wenden Sie die Lehren der Thermodynamik nicht auf alles im Alltag
an!
{Wenn Sie von hier [A] nach Berlin [B] fliegen,
aber für den Rückflug einen Umweg über Hawaii wählen,
werden Sie erkennen, dass "trotz Thermodynamik" der Rückflug
teurer wird.}
|
|
3.
|
Es wird wohl niemand erstaunen, dass die "Thermodynamik"
als Theorie aus mehr als Formulierungen in Worten besteht, sondern
(teilweise nicht mehr ganz einfache) mathematische Formulierungen
enthält.
Erfreulich ist,
dass sich auch ohne viel Mathematik einige wesentliche Ideen verstehen
lassen!
|
ZURÜCK: Woher
Sie gekommen sind - Zustandgrößen


