Tabelliert sind die Werte für
Standardbedingungen, aber natürlich ist eine Umrechung auf andere Bedingungen
möglich!
Der mathematische Formalismus
enthält (wie zu erwarten) die benötigten Formeln.
1. Gegeben sei eine Reaktionsenthalpie bei der
Temperatur T1 ΔHR(T1);
wie groß ist ΔHR(T2)?
|
Die Theorie liefert für ΔH die
Formel:
Darin ist CP(T)
die temperaturabhängige molare
Wärmekapazität
bei konstantem Druck.
|
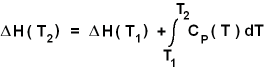
|
|
|
|
In nicht zu großen Temperaturintervallen ist CP
praktisch konstant,
dann vereinfacht sich das Integral zur Endformel:
|
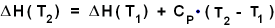
|
Diese Formeln gelten für jede Enthalpie, also auch für die Bildungsenthalpien
ΔHB. Die Reaktionsenthalpie wurde als
Summe "Produkte - Edukte" berechnet. In gleicher Weise kann man ein
ΔCP berechen. Zu beachten ist, dass ΔHB für
Elemente 0 ist, aber CP für Elemente nicht 0 ist. Allgemein
folgt wieder eine Formel mit einem Integral.
|
Wenn temperaturunabhängige CP angenommen werden,
gilt:
|
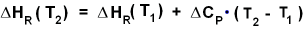
|
Vorher ("Beispiele") haben wir ΔHR für die
Reaktion CO + 1/2 O2 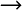 CO2 unter Standardbedingungen (25 °C) berechnet: - 284 kJ/mol.
CO2 unter Standardbedingungen (25 °C) berechnet: - 284 kJ/mol.
Welchen Wert berechnen wir für 300 °C? T2 - T1
= 300 - 25 = 275 °C = 375 K. (Temperaturdifferenzen sind in °C und K
gleich!).
Nach der Reaktionsgleichung ist ΔCP
= CP (CO2) - { CP(CO) + 1/2 * CP(O2)
}
Mit Tabellenwerten (Mittelwerte im Temperaturintervall) ist dies:
ΔCP
= 43 - { 32 + 1/2 * 31 } = 4,5 J K-1 mol-1.
Damit haben
wir: ΔHR (300
°C) = - 284 kJ / mol + 4,5 * 275 J / mol = -284 + 1,2 = -283 kJ /
mol.
{Alle Stoffe sind Gase, die sich ähnlich verhalten;
der Standardwert ist für diesen Fall in einem weiten Temperaturbereich
eine gute Näherung. Wenn nicht sehr präzise Angaben nötig sind,
sind die Rechnungen mit den Werten unter Standardbedingungen gut geeignet, um
das Reaktionsverhalten vorauszusagen.}
2. Die Druckabhängigkeit ist in der
Praxis kaum wichtig. Die Formel zeigt, dass für Gase in guter Näherung
die Druckabhängigkeit gering ist (für ideale Gase sogar exakt 0).
Wichtiger ist die Umrechnung auf andere Stoffmenge
als die Standardbedingung 1 mol. Und dies ist ein einfacher
Dreisatz!
Wenn für die Reaktion von 1 mol CO ΔHR
= - 284 kJ / mol, ist für z.B. 0,4 mol:
DHR
= 0,4 * (-284) = -133,6 kJ! (für 0,4 mol)
Anmerkung: Für die im 4. Kapitel eingeführten
Größen S und G gibt es selbstständlich auch Formeln für
die Umrechnung auf andere Temperaturen! Damit lässt sich das Verhalten
von Stoffen und chemischen Reaktionen für jede Temperatur berechnen -
"wie wir es von einer brauchbaren Theorie erwarten"!
ZURÜCK: Woher
Sie gekommen sind - Bildungsenthalpie
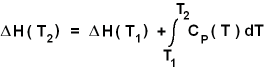
![]()